Glaucome néovasculaire : prévention et traitement
Related content
Les patients présentant une rétinopathie diabétique et une occlusion veineuse rétinienne risquent de développer un glaucome néovasculaire. Il est crucial de détecter cette maladie douloureuse et cécitante à un stade précoce et de la traiter rapidement.
Le glaucome néovasculaire est un glaucome accablant qui survient lorsque la formation de néovaisseaux obstrue le trabéculum (le tissu qui assure le drainage de l’humeur aqueuse). La rétinopathie diabétique (RD) et l’occlusion veineuse rétinienne sont les causes les plus fréquentes de la formation de nouveaux vaisseaux. Il faut toutefois également envisager la possibilité de causes atypiques (voir encadré sur cette page).
Tableau clinique
Aux premiers stades de cette affection, les patients présentent des symptômes de la maladie sous-jacente (la plus courante étant la rétinopathie diabétique), tels qu’un flou visuel, des corps flottants, ou une perte totale de vision due à une hémorragie dans le segment postérieur de l’oeil (hémorragie rétinienne ou intravitréenne). Au fur et à mesure que l’affection évolue et la pression intraoculaire (PIO) augmente, le patient peut présenter une forte douleur oculaire, des maux de tête, une rougeur oculaire, des nausées ou des vomissements.
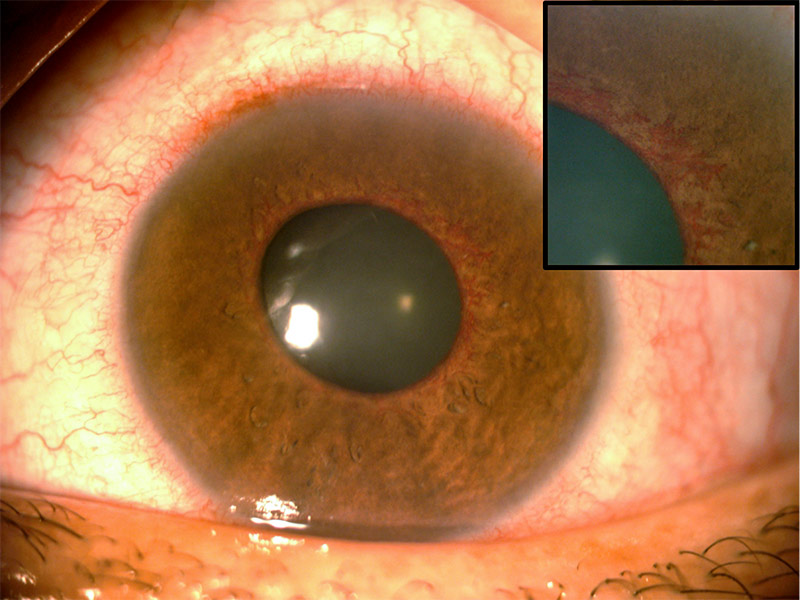
L’examen révèle des vaisseaux sanguins autour de la pupille (néovascularisation irienne ou « rubéose irienne », voir Figure 1). Une lampe torche peut permettre de détecter les gros vaisseaux, mais les vaisseaux plus petits sont plus difficiles à repérer aux stades précoces de cette affection, même à la lampe à fente. Pour détecter la rubéose irienne le plus tôt possible, il est donc important d’examiner l’iris avant dilatation.
Aux stades précoces du glaucome néovasculaire, l’angle irido-cornéen est ouvert. Toutefois, au fur et à mesure que les néovaisseaux se développent, des synéchies antérieures périphériques apparaissent (adhésions de l’iris à la cornée), ce qui peut fermer l’angle et augmenter plus encore la PIO. La pupille tend également à moins réagir à la lumière et évolue jusqu’à un stade où elle est fixe et dilatée et on observe un ectropion de l’uvée autour du bord pupillaire. Les néovaisseaux sont particulièrement fragiles et se rompent parfois spontanément, entraînant un hyphéma dans la chambre antérieure.
Histoire naturelle
Des processus pathologiques oculaires (RD, occlusion veineuse rétinienne, ou autre affection) déclenchent la production de facteurs angiogéniques, tel le facteur de croissance de l’endothélium vasculaire (en anglais vascular endothelial growth factor ou VEGF), qui favorisent la formation de néovaisseaux fragiles ayant tendance à fuir ou à se rompre. Ces néovaisseaux (Figure 1) apparaissent au niveau du bord pupillaire et/ou dans l’angle irido-cornéen. Initialement, la PIO est normale car les néovaisseaux n’obstruent que partiellement l’angle irido-cornéen ; ceci ne suffit pas à entraver l’écoulement et augmenter la PIO.
Puis, au fur et à mesure que les néovaisseaux continuent de se développer, l’écoulement de l’humeur aqueuse diminue et la PIO augmente, bien que l’angle demeure ouvert. Enfin, il se forme des cellules contractiles qui entraînent l’adhésion de l’iris à la face interne de la cornée à la périphérie de l’iris (synéchies antérieures périphériques), ce qui aboutit in fine à l’obstruction complète du trabéculum et entraîne un ectropion de l’uvée au niveau du bord pupillaire. Cette obstruction anatomique du trabéculum évolue vers une fermeture complète de l’angle irido-cornéen (comme s’il se fermait avec une fermeture éclair), et la PIO augmente jusqu’à atteindre des niveaux très élevés. En conséquence, les cellules endothéliales cornéennes ne peuvent plus maintenir la transparence de la cornée et il se forme un oedème de cornée, qui se manifeste par une cornée d’apparence trouble. La rupture de la barrière hémato-aqueuse produit un phénomène de Tyndall dans la chambre antérieure et l’inflammation se manifeste cliniquement par une injection ciliaire et la présence de cellules dans la chambre antérieure.
Le patient va souffrir de douleurs, céphalées, nausées et vomissements pendant plusieurs jours, voire plusieurs semaines. L’augmentation prononcée de la PIO va aussi endommager le nerf optique, avec une perte de vision progressive dans l’oeil affecté.
Dans certains cas, il y a ischémie progressive du corps ciliaire jusqu’à ce que ce dernier ne produise plus d’humeur aqueuse et certains yeux peuvent évoluer jusqu’à une phtisie du globe oculaire (atrophie de l’oeil).
Chez beaucoup de patients diabétiques, la gravité du glaucome néovasculaire ne reflète pas la gravité de l’atteinte oculaire diabétique constatée à l’examen. Par exemple, beaucoup de patients ayant une rétinopathie diabétique proliférante présentent une PIO normale et une absence de néovascularisation du segment antérieur. Inversement, on trouve des patients présentant une acuité visuelle normale chez qui une rétinopathie diabétique proliférante et un glaucome néovasculaire douloureux sont les premiers signes cliniques de maladie oculaire liée au diabète. Par conséquent, tout clinicien évaluant des patients présentant un diabète ou autre pathologie vasculaire rétinienne doit bien connaître le glaucome néovasculaire et doit rechercher une éventuelle néovascularisation du segment antérieur. Les patients présentant un glaucome néovasculaire doivent être orientés d’urgence vers un ophtalmologiste formé au traitement du glaucome et à la prise en charge des causes sous-jacentes.
Causes atypiques de glaucome néovasculaire
- Chez l’enfant, il faut exclure le rétinoblastome et la maladie de Coats.
- En l’absence d’occlusion veineuse rétinienne ou de rétinopathie diabétique bilatérale, songer à un syndrome d’ischémie oculaire et demander une échographie Doppler des carotides.
- Une fois que les causes ci-dessus ont été exclues, envisager une uvéite, d’autres types de tumeur intraoculaire, ou des affections de la rétine périphérique.
Détection
Lorsque vous examinez un patient présentant un glaucome néovasculaire, ou une suspicion de glaucome néovasculaire, posez-vous les questions suivantes :
- Le diagnostic est-il bien un glaucome néovasculaire, ou pourrait-il s’agir d’un autre type de glaucome secondaire ?
- Quelle maladie sous-jacente a entraîné ce glaucome néovasculaire ? La cause en est souvent une rétinopathie diabétique ou une occlusion veineuse rétinienne, mais il faut aussi exclure les causes atypiques (voir encadré à la page 19).
- Quelle est l’ampleur de l’hypertension oculaire ? La maladie est considérée comme grave lorsque le patient développe des signes ou symptômes de PIO très élevée (oedème de cornée, douleur oculaire ou maux de tête).
- L’angle est-il ouvert ou fermé ? (voir l’article sur l’examen gonioscopique en page 10).
- Quel est le potentiel visuel ? On peut s’en faire une idée approximative en se basant sur la gravité des lésions maculaires causées par l’affection sous-jacente et sur la gravité des lésions papillaires causées par le glaucome.
- Quelle est l’espérance de vie du patient ?
- Le patient souffre-t-il d’inconfort ou de douleurs ?
- Le patient présente-t-il des affections générales devant être traitées d’urgence, par ex. une insuffisance rénale ou un cancer ?
Il faut collaborer avec les autres professionnels de la santé impliqués dans le traitement du patient (généraliste, néphrologue, cardiologue, neurologue, nutritionniste). Conseiller aux patients et à leurs aidants d’éviter l’utilisation excessive d’anti-inflammatoires non stéroïdiens contre la douleur, en raison du risque d’hémorragie gastro-intestinale.
Traitement
La prise en charge est difficile et requiert une collaboration étroite entre les différents professionnels de la santé. Elle associe souvent traitement médical et traitement chirurgical ou au laser (voir Tableau 1).
Lorsque l’angle est encore ouvert, un traitement précoce par photocoagulation panrétinienne et injections intravitréennes d’anti-VEGF peut entraîner une régression de la néovascularisation et un retour à la normale de la PIO. Par contre, s’il y a fermeture de l’angle sur 360 degrés (fermeture complète), presque tous les patients devront subir un traitement chirurgical car il devient impossible d’améliorer l’écoulement naturel. Le clinicien ne doit pas oublier qu’une injection intravitréenne peut en soi augmenter la pression oculaire. Une réduction brutale de la PIO avec une paracentèse n’est pas souhaitable, en raison du risque d’hyphéma, d’hémorragie intravitrénne et de rétinopathie de décompression.
Traitement médical
Le traitement médical doit inclure un collyre hypotonisant, ainsi que des collyres corticoïdes et cycloplégiques. L’acétazolamide est utile, mais il faut le prescrire avec prudence car beaucoup de patients souffrent d’insuffisance rénale et prennent déjà plusieurs médicaments. Il faut également éviter de le prescrire à des patients présentant une anémie falciforme (drépanocytose).
Traitement chirurgical
La prise en charge chirurgicale d’une élévation de la PIO va dépendre du pronostic visuel du patient et de son espérance de vie. Chez un patient ayant un mauvais potentiel visuel, une cyclodestruction agressive par laser ou cryothérapie peut réduire efficacement les symptômes et stabiliser en partie la PIO (il est parfois plus facile de combiner ce geste avec une ablation rétininienne périphérique en utilisant la même technique par laser ou cryothérapie).
Pour les patients présentant un bon potentiel visuel, un dispositif de drainage (de type Ahmed ou Baerveldt) offre une alternative à la cyclodestruction. Le choix d’une intervention pour réduire la PIO doit prendre en compte l’espérance de vie présumée du patient, les effets du traitement envisagé sur la qualité de vie du patient, la totalité des coûts (collyre, chirurgie, transport, disponibilité des aidants, absence du travail), ainsi que les croyances du patient et ses préférences.
Lorsque l’oeil est aveugle, il ne faut intervenir que pour traiter la douleur. Il est important de souligner que le glaucome néovasculaire secondaire à une RD peut être asymétrique, mais qu’il est généralement bilatéral. Les cliniciens ne doivent pas se contenter de traiter l’oeil le plus touché par le glaucome néovasculaire ; ils doivent aussi traiter l’oeil le moins affecté par photocoagulation panrétinienne.
Comment prévenir le glaucome néovasculaire
Tous les prestataires de soins de santé (médecins, infirmiers, techniciens, nutritionnistes, agents de santé) doivent encourager les patients à s’impliquer activement dans la prise en charge de leurs maladies préexistantes, par ex. le diabète ou l’hypertension.
- Encourager les patients diabétiques à contrôler leur glycémie. Une glycémie élevée favorise la formation de vaisseaux anormaux.
- Conseiller à tous les patients de subir un examen ophtalmologique une fois par an (ou plus fréquemment si nécessaire).
- Traiter rapidement par photocoagulation panrétinienne toute RD grave ou proliférante.
- Chez les patients présentant une occlusion veineuse rétinienne, pratiquer un examen à la lampe à fente et une gonioscopie pour surveiller de près le segment antérieur (une fois par mois en cas d’ischémie). Rechercher des signes de néovascularisation au niveau de l’iris ou de la chambre antérieure durant les 3 à 6 premiers mois.
- Si la RD ou l’occlusion veineuse rétinienne est traitée par des injections régulières d’anti- VEGF, surveiller de près l’oeil du patient pendant les 3 à 6 mois suivant l’arrêt du traitement.
- Surveiller de près le degré de gravité de la RD après une opération de la cataracte, particulièrement s’il y a eu rupture de la capsule antérieure durant l’intervention.
Tableau 1 Traitement du glaucome néovasculaire en fonction de ses manifestations cliniques (PIO = pression intraoculaire)
| Caractéristiques | PIO | Traitement pour contrôler la PIO | Traitement pour contrôler la néovascularisation |
|---|---|---|---|
| Néovaisseaux (rubéose irienne) au niveau de l’iris ou de la chambre antérieure | Normale | Non | Photocoagulation panrétinienne, cryothérapie rétinienne, ou injection intravitréenne d’anti-VEGF |
| Rubéose irienne avec angle ouvert | Élevée | Collyre hypotonisant ; traitement chirurgical si pas d’amélioration | Photocoagulation panrétinienne, cryothérapie rétinienne, ou injection intravitréenne d’anti-VEGF |
| Rubéose irienne avec angle fermé | Élevée | Traitement chirurgical | Photocoagulation panrétinienne, cryothérapie rétinienne, ou injection intravitréenne d’anti-VEGF |
| Glaucome néovasculaire grave (avec forte douleur ou PIO> 40 mm Hg à la première consultation) | Très élevée | Traitement chirurgical d’urgence pour abaisser la PIO, tel que cyclodestruction ou implantation d’un dispositif de drainage. L’injection intravitréenne d’anti-VEGF, la photocoagulation panrétinienne et la cryothérapie rétinienne seront également nécessaires | |
| Dernier stade (cécité) du glaucome néovasculaire (pas de perception lumineuse) | Faible à très élevée | N’intervenir généralement que pour gérer la douleur : par ex. collyres cycloplégiques ou corticoïdes, ainsi que laser ou chirurgie pour diminuer la PIO |

