Infections à adénovirus : manifestations ophtalmologiques
Related content
Les infections oculaires à adénovirus sont fréquentes et très contagieuses. Il n’existe pas d’antiviraux spécifiques pour les traiter, donc il faut mettre en oeuvre un traitement de soutien et adopter des mesures d’hygiène rigoureuses ; les antibiotiques locaux sont inutiles.
Les personnels de santé oculaire se trouvent souvent face à des infections oculaires à adénovirus, qui sont une cause de conjonctive bilatérale. L’infection à adénovirus se manifeste par une rougeur oculaire d’apparition soudaine (uni ou bilatérale) et un larmoiement clair, souvent associés à un mal de gorge. Le diagnostic différentiel doit exclure une conjonctivite bactérienne (y compris à chlamydia), d’autres causes de conjonctivite virale et, éventuellement, une conjonctivite allergique. Les adénovirus se transmettent facilement et il n’existe pas de traitement spécifique.
Les adénovirus comprennent 51 types distincts de virus à ADN bicaténaire, de structure semblable mais ayant descaractéristiques antigéniques différentes (sérotypes)1. Ces virus extrêmement stables se retrouvent partout dans le monde et entraînent des infections respiratoires, génito-urinaires, gastro-intestinales et oculaires. Une infection à adénovirus est généralement auto-limitante, mais elle peut entraîner une défaillance multiviscérale fatale chez les individus immunodéprimés.
Les infections à adénovirus, comme la plupart des causes de conjonctivite virale, sont extrêmement contagieuses : on estime que le taux de transmission intrafamilial se situe entre 10 % et 50 %2,3. Ces virus peuvent se transmettre par l’intermédiaire de mains, serviettes et mouchoirs contaminés, par exemple à la piscine, et par l’intermédiaire d’instruments et équipements médicaux ; il est également possible que ces virus puissent se transmettre par des aérosols générés par des éternuements. Tout ce que touche un patient, et tout ce qui entre en contact avec un patient, est une source potentielle de contamination.
Pour prévenir la transmission des infections dans votre centre de soins oculaires :
- Respectez scrupuleusement les règles d’hygiène des mains avant et après le contact avec chaque patient.
- Après chaque patient, nettoyez avec des lingettes désinfectantes les instruments et équipements d’ophtalmologie que vous venez d’utiliser.
En cas de suspicion ou de confirmation d’infection à adénovirus :
- Si possible, placez les patients présentant une suspicion d’infection adénovirale dans une salle d’attente séparée. Utilisez également une salle de consultation séparée, si possible.
- Utilisez des gants jetables.
- Évitez si possible tout contact entre l’oeil et les instruments.
- Si un des instruments est entré en contact avec l’oeil ou les mains d’un patient ou d’un membre du personnel de santé, faites tremper l’instrument dans une solution d’hypochlorite de sodium (eau de Javel) pendant au moins 10 minutes avant de le réutiliser.
Phénotypes cliniques
La conjonctivite à adénovirus se présente sous la forme de quatre tableaux cliniques :
- Kératoconjonctivite épidémique
- Fièvre pharyngoconjonctivale
- Conjonctivite folliculaire aiguë non spécifique
- Kératoconjonctivite chronique.
Kératoconjonctivite épidémique


La kératoconjonctivite épidémique (EKC, de l’anglais epidemic keratoconjunctivitis) est la forme la plus grave des infections à adénovirus. Elle est généralement associée aux sérotypes 8 et 19, bien que des associations avec d’autres sérotypes aient été parfois constatées4,5. La transmission se produit lorsque deux personnes sont en contact étroit. Cette conjonctivite affecte typiquement les jeunes adultes en automne et en hiver, est unilatérale dans deux-tiers des cas, et ne s’accompagne pas de symptômes généraux. Ceci contraste avec ce que l’on observe en cas de fièvre pharyngoconjonctivale, où les symptômes sont généralement bilatéraux et associés aux symptômes généraux que sont le mal de gorge et la fièvre.
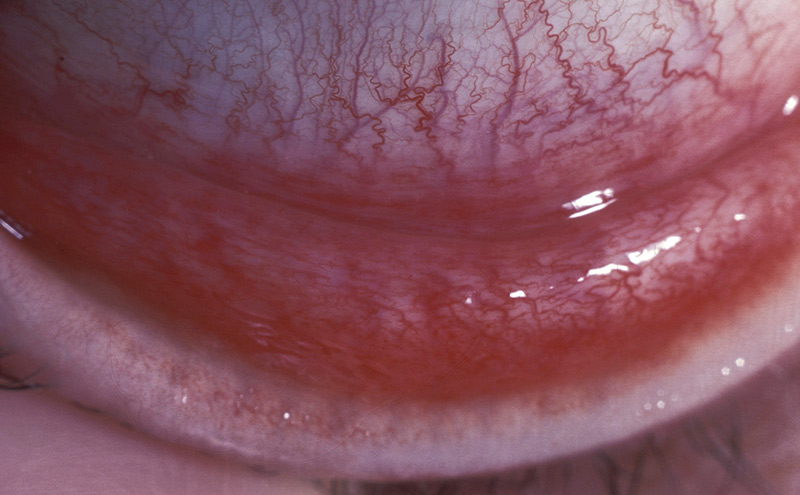
Après une période d’incubation de huit jours, le patient présentera une rougeur conjonctivale importante, un larmoiement clair et une sensation de corps étranger dans l’oeil. Les signes observés incluent des ganglions lymphatiques préauriculaires enflés et douloureux au toucher (lymphadénopathie préauriculaire, observée dans 50 % des cas), ainsi que la présence de follicules sur la conjonctive tarsale (Figure 1). La présence simultanée de ces deux signes suggère fortement une conjonctive à adénovirus et devrait vous aider à poser un diagnostic.
On peut également observer d’autres signes et symptômes, notamment une photophobie légère, un oedème conjonctival, de petites hémorragies sous-conjonctivales, ainsi que la présence de pseudomembranes ou de vraies membranes susceptibles de saigner durant l’ablation (Figure 2). Plus rarement, on peut observer la formation de symblépharons et celle de tissu cicatriciel au niveau du tarse (Figure 3). Lorsque l’autre oeil est infecté, cela se produit généralement 4 à 5 jours après le début de la maladie et les signes sont habituellement moins graves que dans le premier oeil, parce que le patient a acquis une immunité partielle7.
Kératite adénovirale
Stade 1 Kératite ponctuée superficielle épithéliale, légère et diffuse
Stade 2 Lésions épithéliales blanches ponctuées, focalisées et fixant le colorant
Stade 3 Zones combinant lésions épithéliales et sous-épithéliales
Stade 4 Lésions maculaires sous-épithéliales ne fixant pas le colorant
On distingue quatre stades de la kératite (voir encadré et Figure 4)4,7–9.
- Le Stade 1 se produit généralement dans la semaine qui suit le début de la conjonctivite à adénovirus ; les symptômes sont un inconfort grandissant, une photophobie et un larmoiement. Ils sont dus à une kératite ponctuée superficielle épithéliale diffuse, qui est directement causée par la présence de virus actif.
- Le Stade 2 se caractérise par des lésions épithéliales blanches ponctuées, qui fixent la fluorescéine ; ce stade se produit rapidement après le Stade 1.
- Le Stade 3 se produit au bout de 24 à 48 heures supplémentaires ; on observe des zones combinant lésions épithéliales et sous-épithéliales.
- Stade 4 : la conjonctivite adénovirale commence à se résorber et le patient présente des lésions sous-épithéliales résiduelles qui ne fixent pas le colorant (Figure 4).

On estime que les Stades 2 à 4 se développent à la suite d’une réaction d’hypersensibilité retardée aux antigènes viraux sous-épithéliaux7,8.
La conjonctivite à adénovirus trouve sa résolution au bout de deux à trois semaines, alors que le Stade 4 de la kératite atteint son point culminant entre la troisième et la quatrième semaine. À ce moment-là, il peut y avoir perte d’une ou deux lignes d’acuité visuelle. Ces lésions sous-épithéliales peuvent perdurer pendant des mois ou même, rarement, pendant des années ; elles se résolvent cependant sans aucun tissu cicatriciel et l’acuité visuelle retrouve son niveau antérieur.
Fièvre pharyngoconjonctivale
La fièvre pharyngoconjonctivale (PCF, de l’anglais pharyngoconjunctival fever) est associée aux sérotypes 3, 4 et 7 de l’adénovirus1,7. Elle est extrêmement contagieuse et se transmet rapidement d’un individu à l’autre lorsque des personnes vivent ou travaillent en contact étroit. Contrairement à ce qu’on observe dans le cas de la kératoconjonctivite épidémique (EKC), les symptômes généraux sont ici prédominants, notamment la pharyngite, la fièvre, des ganglions préauriculaires douloureux au toucher et une conjonctivite folliculaire aiguë.
La période d’incubation est d’environ huit jours (amplitude : 5 à 12 jours) après exposition, lorsque les patients développent de la fièvre associée à des courbatures, un sentiment d’inconfort et, de temps en temps, des troubles gastro-intestinaux1,7. Une conjonctivite folliculaire aiguë se développe quelques jours après le début de la maladie symptomatique, les premiers symptômes étant une irritation, une sensation de brûlure et un larmoiement. La conjonctivite est généralement plus grave dans le cul-de-sac conjonctival inférieur et il peut en résulter une paupière inférieure oedémateuse et douloureuse au toucher, parfois avec une ecchymose qui ressemble à un traumatisme orbitaire. Les deux yeux sont généralement affectés, bien qu’il puisse s’écouler un à trois jours avant que le deuxième oeil devienne problématique (Figure 5).

La kératite adénovirale est moins courante dans les cas de fièvre pharyngoconjonctivale que dans les cas d’EKC ; toutefois, si elle est présente, elle suit la même progression en quatre stades que nous avons décrit plus haut.
Conjonctivite folliculaire aiguë non spécifique
Cette forme de conjonctivite à adénovirus est causée par de nombreux sérotypes d’adénovirus. Il s’agit toutefois d’une conjonctivite légère et autolimitante, qui se rencontre fréquemment chez l’enfant et le jeune adulte, et se résout dans les 7 à 10 jours suivant l’apparition des symptômes. La conjonctivite à adénovirus se caractérise par une sensation de douleur au toucher, un larmoiement, une rougeur conjonctivale et la présence de follicules au niveau du tarse ; la cornée n’est pas impliquée. Le diagnostic différentiel doit exclure une conjonctivite folliculaire aiguë à chlamydia ou à herpès simplex.
Kératoconctivite chronique
Des cas de kératoconjonctivite chronique à adénovirus ont été rapportés, mais ils sont rares 10–12. Cliniquement, le patient souffre depuis longtemps et par intermittence d’injection conjonctivale, de larmoiement et de photophobie. Il y aura des antécédents de conjonctivite virale au cours des 6 à 9 derniers mois. Le diagnostic peut s’avérer difficile car, contrairement à ce que l’on observe dans le cas des autres types de conjonctivite à adénovirus, ce sont les papilles conjonctivales qui prédominent plutôt que les follicules. Des examens de laboratoire (voir ci-après) peuvent permettre de confirmer le diagnostic.
Examens
Des examens de laboratoire ne sont généralement pas nécessaires pour diagnostiquer une conjonctivite à adénovirus, car le diagnostic peut se faire de manière clinique, particulièrement s’il y a présence de follicules conjonctivaux et si les ganglions préauriculaires sont douloureux au toucher, en l’absence d’écoulement purulent important. Si vous faites réaliser des examens en cas de suspicion de conjonctivite à adénovirus, recherchez également la présence d’une infection bactérienne ou à chlamydia, ainsi qu’un ensemble de virus, y compris adénovirus et virus de l’herpès simplex.
Parmi les examens de laboratoire possibles, on peut citer l’amplification en chaîne par polymérase (PCR) en temps réel, les tests antigéniques rapides, la mise en culture du virus et les analyses sérologiques recherchant des IgM spécifiques du virus ou une augmentation dans le temps du taux d’anticorps spécifiques7. Parmi ces examens, la PCR est devenue le test de laboratoire idéal, bien qu’elle ne soit pas disponible partout, car c’est un test diagnostique à spécificité et sensibilité élevées dont le résultat peut être obtenu rapidement13.
Les tests antigéniques rapides ont une sensibilité et une spécificité de 89 % et 94 %, respectivement14. Ce type de test peut être réalisé directement dans le lieu de soins et, bien qu’il soit relativement coûteux, il peut s’avérer très utile dans un établissement de santé primaire car il prévient un diagnostic erroné de conjonctivite bactérienne et donc un traitement antibiotique inutile.
Traitement
Il n’existe pas de traitement homologué spécifique pour la prise en charge de la conjonctivite à adénovirus. Les recommandations actuelles visent à soulager les symptômes avec l’instillation de larmes artificielles et l’application de compresses froides sur les yeux15. Les antibiotiques n’ont aucun rôle à jouer car ils ne protègent pas contre l’infection secondaire. Leur utilisation abusive peut entraîner non seulement une résistance bactérienne, mais également une confusion diagnostique car les collyres antibiotiques peuvent avoir un effet local toxique ou allergénique2,6. En dehors de ces recommandations, la prise en charge est controversée.
Les antiviraux cidofovir et ganciclovir ont fait l’objet de recherches, mais il existe peu de preuves pouvant justifier leur utilisation régulière16–19.
L’administration de gouttes de povidone iodée est un autre traitement potentiel de la conjonctivite à adénovirus16. Les études examinant l’utilisation de povidone iodée en association avec des corticoïdes locaux (dexaméthasone 0,1 %) ont montré une diminution des symptômes et une réduction de la charge virale, chez l’homme comme chez le lapin17,18. Les résultats d’un essai comparatif aléatoire en phase 2, publiés récemment, suggèrent que l’association de povidone iodée et de dexaméthasone a un effet bénéfique en termes de rapidité de résolution de la maladie et d’éradication du virus ; ce traitement n’est toutefois pas encore disponible dans le commerce et ses effets secondaires dus aux corticoïdes, potentiellement importants, n’ont pas fait l’objet d’une enquête approfondie19,20.
Outre les antiviraux, l’utilisation des corticoïdes locaux dans le traitement d’une infection adénovirale suscite également la controverse. Bien que les corticoïdes locaux puissent accélérer la disparition des signes cliniques et soulager les symptômes, leur utilisation est liée à une augmentation de l’excrétion virale et à une durée d’infection active supérieure aux 12 jours habituels, ce qui signifie que le patient reste infectieux plus longtemps21,22. Ceci peut avoir des implications de santé publique, car la quantité de virus circulant dans la population et dans l’environnement (le réservoir viral) sera plus importante.
Si le patient présente une kératite adénovirale sous-épithéliale, des corticoïdes locaux permettront une réduction ou une élimination rapide des opacités sous-épithéliales, ce qui améliorera l’acuité visuelle. Toutefois, en général, lorsque l’on arrête le traitement corticoïde local, les opacités réapparaissent ; elles ne s’atténuent qu’avec le temps8. Il faut toujours prendre en compte les effets secondaires bien connus des corticoïdes locaux (augmentation de la pression intraoculaire et risque d’apparition d’une cataracte). Toutefois, il sera raisonnable d’utiliser des corticoïdes locaux pour traiter des patients présentant des pseudomembranes ou membranes importantes, ce afin de réduire le risque de formation de symblépharons. Par ailleurs, lorsqu’un patient présente une baisse importante d’acuité visuelle due à la présence d’opacités cornéennes sous-épithéliales, il pourra aussi tirer bénéfice de ce traitement, à condition qu’on lui explique bien ses effets secondaires et le risque de réapparition des opacités à l’arrêt du traitement.
Conclusion
Les infections oculaires à adénovirus sont extrêmement contagieuses et se présentent généralement sous la forme d’une conjonctivite folliculaire avec lymphadénopathie préauriculaire. Bien que ces infections soient souvent autolimitantes, certains sous-types sont associés à une affection de longue durée et une morbidité importante ; par ailleurs, il ne faut pas négliger le coût économique important associé à ces infections. À l’heure actuelle il n’existe pas de traitement homologué pour cette affection courante et on recommande un simple traitement de soutien, bien que des essais cliniques soient en cours.
Références
1 Baum S. Adenovirus. In: Mandell, Douglas, and Bennett’s principles and practice of infectious diseases. Churchill Livingstone; 2010.
2 Kaufman HE. Curr Opin Ophthalmol 2011 ; 22 : 290–293.
3 Høvding G. Acta Ophthalmol 2008 ; 86 : 5–17.
4 Murrah WF. Ann Ophthalmol 1988 ; 20 : 36–38.
5 O’Day DM et al. Am J Ophthalmol 1976 ; 81 : 207–215.
6 O’Brien TP et al. Curr Med Res Opin 2009 ; 25 : 1953–1961.
7 Pavan-Langston D. Viral Disease of the Cornea and External Eye. In : Albert & Jakobiec’s Principles and Practice of Ophthalmology. 2008.
8 Laibson PR et al. Arch Ophthalmol 1970;84:36–40.
9 Dawson CR et al. Am J Ophthalmol 1970;69:473–480.
10 Boniuk M et al. New Engl J Med 1965 ; 273 : 924–925.
11 Darougar S et al. Brit J Ophthalmol 1977 ; 61 : 76–85.
12 Pettit TH, Holland GN. Am J Ophthalmol 1979;88:748–751.
13 Kowalski RP et al. Arch Ophthalmol 2006 ; 124 : 1135–1139.
14 Sambursky R et al. Ophthalmology 2006 ; 113 :1758–1764.
15 Azari AA, Barney NP. JAMA 2013 ; 310 : 1721–9.
16 Pihos AM. J Optom 2013 ; 6 : 69–74.
17 Pelletier JS et al. Adv Ther 2009 ; 26 : 776–783. 18 Clement C et al. Invest Ophthalmol Vis Sci 2011 ; 52 : 339–344.
19 Pepose JS et al. Am J Ophthalmol 2019 ; 205 : 197.
20 Ramakrishnan S et al. Am J Ophthalmol 2019 ; 204 : 140.
21 Romanowski EG et al. Arch Ophthalmol 1996 ; 114 : 581–585.
22 Romanowski EG et al. Cornea 2002 ; 21 : 289–291.

